Водородное соединение фтора проявляет более сильные кислотные свойства чем йода
Водородное соединение фтора проявляет более сильные кислотные свойства чем йода
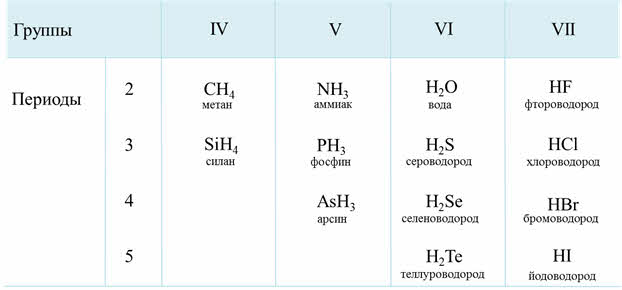
Водородные соединения неметаллов представляют собой газообразные соединения, кроме воды. Они летучие и легкоподвижные, быстроиспаряемые.
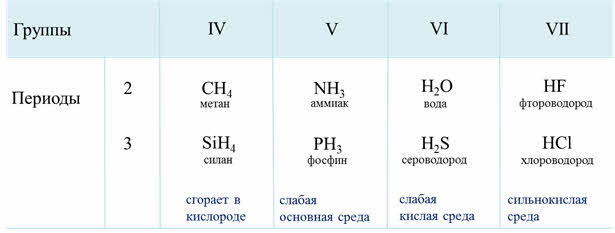
Электроотрицательность неметаллов больше электроотрицательности водорода, поэтому в водородных соединениях неметаллы проявляют минимальную отрицательную степень окисления: углерод — минус четыре, азот — минус три, фосфор — минус три и так далее.
Водородные соединения неметаллов проявляют основные, кислотные или амфотерные свойства. Водородные соединения неметаллов являются, как правило, сильными восстановителями.
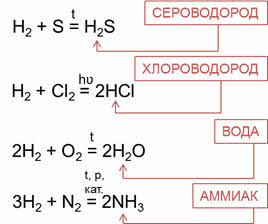
Водородные соединения неметаллов можно получить непосредственно взаимодействием неметалла с водородом. Сероводород можно получить реакцией водорода с серой, хлороводород – реакцией водорода с хлором, воду – реакцией водорода и кислорода, аммиак – реакцией водорода и азота.
В водородных соединениях присутствует ковалентная полярная связь, они имеют молекулярную кристаллическую решётку.
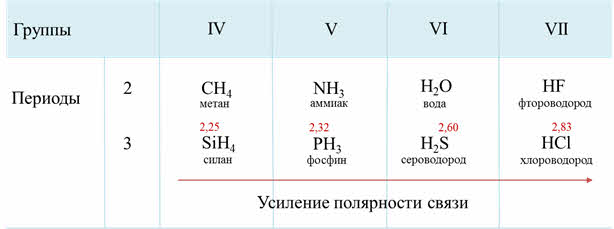
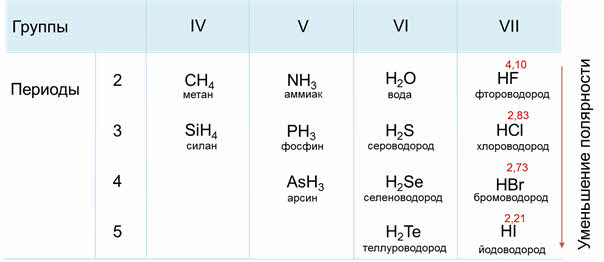
Как известно, электроотрицательность усиливается по периоду слева направо, поэтому полярность связи в водородных соединениях возрастает, а в группах сверху вниз электроотрицательность уменьшается, поэтому и полярность связи будет уменьшаться.
Если рассмотреть третий период, то от силена до хлороводорода будет наблюдаться усиление полярности связи из-за увеличения электроотрицательности неметаллов.
В седьмой A группе сверху вниз будет идти уменьшение полярности связи от фтороводорода к йодоводороду, потому что идёт уменьшение электрооотрицательности элемента-неметалла в водородном соединении.
Полярность связи влияет на растворимость водородного соединения в воде. Например, так как молекула воды сильно полярна, то возникает сильное межмолекулярное взаимодействие с образованием водородных связей.
Если рассмотреть водородные соединения неметаллов третьего периода, то здесь можно проследить следующую закономерность: при растворении в воде силана не наблюдается проявление кислотно-основного характера соединения, он сразу сгорает в кислороде, фосфин в воде даёт слабую основную среду, сероводород – слабую кислую среду, а хлороводород – сильнокислую среду. Это объясняется тем, что от силана до хлороводорода радиус иона неметалла уменьшается, а заряд ядра увеличивается, полярность связи в молекулах возрастает, поэтому усиливаются кислотные свойства.
В группах сверху вниз кислотные свойства водородных соединений неметаллов усиливаются, так как прочность связи водород-элемент уменьшается, из-за увеличения длины связи.
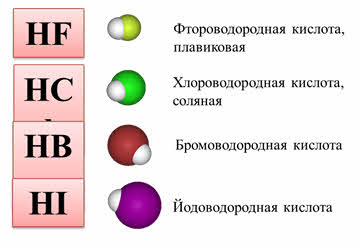
Например, водородные соединения седьмой A группы: хлороводород, бромоводород, йодоводород в воде – это сильные кислоты, которые полностью диссоциируют. Из этих кислот самой слабой является фтороводородная. Это объясняется тем, что у фтора самый маленький радиус, кроме этого, в этой молекуле присутствуют межмолекулярные водородные связи.
Таким образом, в периодах и группах главных подгруппах с увеличением заряда ядер элементов-неметаллов усиливаются кислотные свойства, а ослабевают основные свойства.
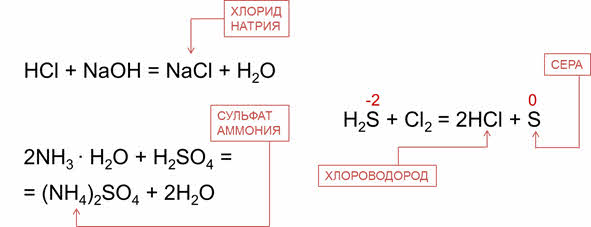
Например, водный раствор хлороводорода – проявляет кислотные свойства, поэтому реагирует со щелочами. Так, в реакции соляной кислоты с гидроксидом натрия образуется соль – хлорид натрия и вода. Водный раствор аммиака проявляет основные свойства, поэтому реагирует с кислотами. Так, в реакции аммиака с серной кислотой образуется сульфат аммония и вода.
Как было сказано, водородные соединения неметаллов проявляют восстановительные свойства, так как элемент-неметалл здесь в минимальной степени окисления. Например, в реакции сероводорода с хлором сероводород является восстановителем, потому что сера повышает свою степень окисления с минус двух до нуля.
Таким образом, все солеобразующие оксиды, образованные неметаллами, обладают кислотными свойствами, а сила кислотного оксида зависит от степени окисления неметалла и радиуса иона. В периодах слева направо кислотный характер гидроксидов, образованных оксидами неметаллов усиливается, а в группах сверху вниз кислотный характер гидроксидов ослабевает. В периодах слева направо кислотные свойства летучих водородных соединений элементов в водных растворах усиливаются. В группах сверху кислотные свойства водородных соединений увеличиваются. Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами, реагируют с кислотами.
Домашнее задание: выполните в тетрадь один из предложенных вариантов.
Цель: Рассмотрите строение метана и силана, особенности их свойств.
1. Строение молекулы метана.
а) определите тип химической связи, изобразите механизм образования химической связи в молекуле метана;
б) составьте электронную и структурную формулы метана;
в) охарактеризуйте пространственное строение метана;
г) исчерпаны ли валентные возможности атома углерода в молекуле метана;
2. Химические свойства метана.
а) отношение к воде;
б) взаимодействие с галогенами, азотной и серной кислотами. Составьте УХР этих взаимодействий.
в) отношение к нагреванию без доступа кислорода воздуха. Составьте УХР разложения метана.
г) взаимодействие СН4 и SiH4 с кислородом. Составьте УХР горения метана и силана. Чем отличаются реакции взаимодействия с кислородом метана и силена?
Цель: Изучить строение и свойства водородных соединений азота и фосфора.
1. Строение молекул аммиака и фосфина.
а) определите тип химической связи в молекулах NH3 и PH3. Какой тип кристаллической решетки имеют вещества?
б) опишите физические свойства этих соединений.
в) составьте электронную формулу аммиака, охарактеризуйте пространственное строение аммиака.
2. Химические свойства аммиака.
а) отношение аммиака к воде и кислотам. Составьте УХР этих взаимодействий.
б) окислительно – восстановительные свойства аммиака. Составьте УХР следующих взаимодействий:
— взаимодействие с кислородом при различных условиях;
— взаимодействие с оксидом меди ( II );
— хлор и бром энергично окисляют аммиак до азота.
Чем в этих ОВР выступает аммиак?
Демонстрация: Получение аммиака и растворение его в воде.
Цель: Изучить строение молекулы воды и ее свойства.
а) Составьте электронную и структурную формулы молекулы воды;
б) Каково пространственное строение молекулы воды?
в) Исчерпаны ли валентные возможности воды?
г) Физические свойства воды.
2. Химические свойства воды.
а) отношение воды к неорганическим веществам:
— кислотным и основным оксидам;
Составить возможные УХР.
б) отношение к органическим веществам:
— сложным эфирам (жирам);
Составьте возможные УХР.
в) окислительно-восстановительные свойства воды:
— взаимодействие воды с натрием, углем.
Цель: Изучить строение и свойства сероводорода.
1. Строение молекулы сероводорода:
а) Составьте электронную и структурную формулы молекулы H2S
б) Особенности пространственного строения молекулы сероводорода.
2. Физические и химические свойства сероводорода:
а) особенности физических свойств;
б) химические свойства:
— кислотно-основные (приведите примеры УХР, где сероводород проявляет кислотные свойства);
Составить УХР горения H 2 S в кислороде. Закончите УХР взаимодействия сероводорода с раствором перманганата калия в кислой среде (уравнять методом полуреакций).
Цель: Рассмотреть строение и свойства галогеноводородов.
1. На примере хлороводорода рассмотрите электронное строение молекулы. Изобразите электронную и структурную формулы молекулы хлороводорода.
2. Как изменяется сила кислот в ряду HF-HCl-HBr-HI? Почему?
3. Химические свойства галогеноводородов на примере HCl.
— охарактеризуйте отношение водородных соединений галогенов к органическим веществам:
Составьте возможные УХР взаимодействия HCl с органическими веществами.
Домашнюю работу высылать не нужно, просмотрю в школе
Водородное соединение фтора проявляет более сильные кислотные свойства чем йода
3680 дн. с момента
как существует сайт
Владельцы сайта
Галогены
Химия неметаллов VIIA группы.mp4
Галогены – это элементы VII A группы главной подгруппы. К ним относятся: фтор, хлор, бром, йод и астат, который очень редко встречается в природе.
Все эти элементы являются типичными неметаллами. Галогены, означает « рождающие соли»
Рассмотрим таблицу, в которой отражены физические свойства галогенов.
Фтор является светло-жёлтым газом, хлор – жёлто-зелёный газ, бром – бурая жидкость, а йод – твёрдое вещество чёрно-серого цвета.


И з таблицы видно, что с ростом молекулярной массы увеличиваются температуры кипения и плавления галогенов, их плотность.
Это связано, прежде всего, с увеличением размеров атомов и молекул, а, следовательно, и силами межмолекулярного взаимодействия.
От фтора к йоду усиливается интенсивность окраски галогенов, а у кристаллов йода появляется металлический блеск.
Галогены – химически активные соединения, их активность уменьшается от фтора к йоду.
Фтор самый активный галоген, который при нагревании реагирует даже с золотом, серебром и платиной. Алюминий и цинк в атмосфере фтора воспламеняются.
Галогены
1. Электролиз растворов и расплавов галогенидов:
2 KF = 2 K + F 2 (единственный способ полученияя F 2 )
2. Окисление галогенводородов:
2 KMnO 4 +16 HCl =2 KCl +2 MnCl 2 +5 Cl 2 +8 H 2 O – лабораторный способ получения хлора
Получение хлора.mp4
3. Промышленный способ – окисление хлором (для брома и йода):
Реакции с металлами
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
2Al + 3F 2 → 2 AlF 3
Взаимодействие хлора с медью.mp4
Реакции с неметаллами
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
Cl 2 + H 2 →2 HCl (на свету)
Взаимодействие хлора с водородом.mp4
F 2 + H 2 → 2HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность 😉
Р хлор.mp4
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
2H 2 O + 2F 2 →4 HF + O 2
Cl 2 + H 2 O → HCl + HClO
H 2 O + Br 2 → HBr + HBrO
Cl 2 + 2NaOH → NaCl + NaClO + H 2 O
3Cl 2 + 6NaOH → 5NaCl + NaClO 3 + 3H 2 O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
2KCl + F 2 → 2KF + Cl 2
2KBr + Cl 2 → 2KCl + Br 2
KBr + I 2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Взаимодействие хлора с органическими веществами
Взаимодействие хлора со скипидаром.mp4
Виртуальная практическая работа
Лабораторная работа “Химические свойства галогенов” (проделайте опыты, уравнения реакций можно не составлять)
Модуль включает модели приборов и веществ, необходимых для изучения химических свойств хлора, инструкцию, указывающую порядок действий. Ученику предлагается провести взаимодействие хлора с серой и медью, сфотографировать результаты взаимодействия.
Если Вы хорошо изучили эту часть урока, вставьте 5 пропущенных слов в тексте.
химические свойства галогенов
5 пропущенных слов
Галогеноводороды
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
NaCl + H 2 SO 4 → NaHSO 4 + HCl↑
CaF 2 + H 2 SO 4 → CaSO 4 + 2HF
PBr 3 + 3H 2 O → 3HBr↑ + H 3 PO 3
H 2 S + I 2 → S + 2HI
Mg + 2HBr → MgBr 2 + H 2 ↑
Zn + 2HCl → ZnCl 2 + H 2 ↑
Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
Na 2 O + 2HCl → 2NaCl + H 2 O
ZnO + 2HI → ZnI 2 + H 2 O
KOH + HCl → KCl + H 2 O (реакция нейтрализации)
Cr(OH) 3 + 3HCl → CrCl 3 + 3H 2 O
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
AgNO 3 + HCl → AgCl + HNO 3
Li 2 CO 3 + 2HBr →2 LiBr + H 2 CO 3
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
4HI + MnO 2 → I 2 + MnI 2 + 2H 2 O
2HI + H 2 SO 4 → I 2 + H 2 S + H 2 O
4HI + O 2 → 2H 2 O +2 I 2
2HI + Br 2 → 2HBr + I 2
2HCl + H 2 SO 4 → Cl 2 + SO 2 + 2H 2 O
В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO 2 с плавиковой кислотой.
SiO 2 + 4HF → SiF 4 + 2H 2 O
Растворение стекла в плавиковой кислоте.mp4
Обнаружить ионы галогенов возможно воздействием на растворы солей, содержащих галоген ион нитратом серебра (AgNO3). При наличии хлор-иона образуется белый творожистый осадок хлорида серебра: NaCl + AgNO3 → NaNO3 + AgCl↓ При наличии бром-иона образуется бледно-желтый творожистый осадок бромида серебра: NaBr + AgNO3 → NaNO3 + AgBr↓ При наличии бром-иона образуется желтый творожистый осадок иодида серебра: NaJ + AgNO3 → NaNO3 + AgJ↓
Осадки не растворимы в воде и азотной кислоте.
Применение галогенов и их соединений
Природное соединение фтора — криолит Na 3AlF 6 — применяется при получении алюминия. Соединения фтора используются в качестве добавок в зубные пасты для предотвращения заболеваний кариесом.
Хлор широко используется для получения соляной кислоты, в органическом синтезе при производстве пластмасс и синтетических волокон, каучуков, красителей, растворителей и др. Многие хлорсодержащие соединения используют для борьбы с вредителями в сельском хозяйстве. Хлор и его соединения применяются для отбеливания льняных и хлопчатобумажных тканей, бумаги, обеззараживания питьевой воды. Правда, применение хлора для обеззараживания воды далеко не безопасно, для этих целей лучше использовать озон. Простые вещества и соединения брома и иода используются в фармацевтической и химической промышленности.
Токсичность галогенов
Вследствие высокой реакционной способности (особенно это ярко проявляется у фтора) все галогены являются ядовитыми веществами с сильно выраженным удушающим и поражающим ткани воздействиями.Большую опасность представляют пары и аэрозоль фтора, так как в отличие от других галогенов имеют довольно слабый запах и ощущаются только в больших концентрациях.
Галогены. Химия галогенов и их соединений
Галогены
Положение в периодической системе химических элементов
Галогены расположены в главной подгруппе VII группы (или в 17 группе в современной форме ПСХЭ) периодической системы химических элементов Д.И. Менделеева.
Электронное строение галогенов
Электронная концигурация хлора :
Атомы галогенов содержат на внешнем энергетическом уровне 1 неспаренный электрон и три неподеленные электронные пары в основном энергетическом состоянии. Следовательно, в основном состоянии атомы галогенов могут образовывать 1 связи по обменному механизму.
При этом у фтора возбужденного состояния нет, т.е. максимальная валентность фтора в соединения равна I.
Однако, в отличие от фтора, за счет вакантной d-орбитали атомы хлора, брома и йода могут переходить в возбужденное энергетическое состояние.
Таким образом, максимальная валентность галогенов (кроме фтора) в соединениях равна VII. Также для галогенов характерны валентности I, III, V.
Физические свойства и закономерности изменения свойств
Галогены образуют двухатомные молекулы состава Hal2. В твёрдом состоянии имеют молекулярную кристаллическую решетку. Плохо растворимы в воде, все имеют запах, летучи.
| Галоген | F | Cl | Br | I |
| Электронная формула | … 2s 2 2p 5 | … 3s 2 3p 5 | … 4s 2 4p 5 | … 5s 2 5p 5 |
| Электроотрицательность | 4,0 | 3,0 | 2,8 | 2,5 |
| Степени окисления | -1 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 |
| Агрегатное состояние | Газ | Газ | Жидкость | Твердые кристаллы |
| Цвет | Светло-желтый | Жёлто-зелёный | Буровато-коричневый | Тёмно-серый с металлическим блеском |
| Запах | Резкий | Резкий, удушливый | Резкий, зловонный | Резкий |
| T плавления | –220 о С | –101 о С | –7 о С | 113,5 о С |
| Т кипения | –188 о С | –34 о С | 58 о С | 185 о С |
Внешний вид галогенов:
Фтор
Хлор
Бром
В природе галогены встречаются в виде соединений, в основном, в виде галогенидов.
Соединения галогенов
Типичные соединения хлора:
| Степень окисления | Типичные соединения |
| +7 | Хлорная кислота HClO4 Перхлораты MeClO4 |
| +5 | Хлорноватая кислота HClO3 Хлораты MeClO3 |
| +3 | Хлористая кислота HClO2 |
| +1 | Хлорноватистая кислота HClO Гипохлориты MeClO |
| –1 | Хлороводород HCl, Хлориды MeCl |
Бром и йод образуют подобные соединения.
Способы получения галогенов
1. Получение хлора.
В промышленности хлор получают электролизом расплава или раствора хлорида натрия.
Электролиз расплава хлорида натрия.
В расплаве хлорид натрия диссоциирует на ионы:
NaCl → Na + + Cl −
На катоде восстанавливаются ионы натрия:
K(–): Na + +1e → Na 0
На аноде окисляются ионы хлора:
A(+): 2Cl − ̶ 2e → Cl2 0
Ионное уравнение электролиза расплава хлорида натрия:
2Na + + 2Cl − → 2Na º + Cl2º
Суммарное уравнение электролиза расплава хлорида натрия:
2NaCl → 2Na + Cl2
Электролиз раствора хлорида натрия.
В растворе хлорид натрия диссоциирует на ионы:
NaCl → Na + + Cl −
На катоде восстанавливаются молекулы воды:
K(–): 2H2O + 2e → H2° + 2OH −
На аноде окисляются ионы хлора:
A(+): 2Cl − ̶ 2e → Cl2 0
Ионное уравнение электролиза раствора хлорида натрия:
Суммарное уравнение электролиза раствора хлорида натрия:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2↑
В лаборатории хлор получают взаимодействием концентрированной соляной кислоты с сильными окислителями.
Или перманганатом калия:
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
Бертолетова соль также окисляет соляную кислоту:
KClO3 + 6HCl → KCl + 3Cl2↑ + 3H2O
Бихромат калия окисляет соляную кислоту:
2. Получение фтора.
Фтор получают электролизом расплава гидрофторида калия.
3. Получение брома.
Бром можно получить окислением ионов Br – сильными окислителями.
2HBr + Cl2 → Br2 + 2HCl
Соединения марганца также окисляют бромид-ионы.
4. Получение йода.
Йод получают окислением ионов I – сильными окислителями.
2KI + Cl2 → I2 + 2KCl
Соединения марганца также окисляют йодид-ионы.
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
3Cl2 + 2Fe → 2FeCl3
Аналогичная ситуация с медью : фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример : алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Бром также реагирует с водородом с образованием бромоводорода:
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Cl2 + H2O ↔ HCl + HClO
Фтор реагирует с водой со взрывом:
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
Еще пример : хлор растворяется в холодном растворе гидроксида кальция:
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Cl2 + F2 → 2Cl + F –
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Также галогены окисляют пероксиды:
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип.)
Галогеноводороды
Строение молекулы и физические свойства
Галогеноводороды HHal – это бинарные соединения водорода с галогенами, которые относятся к летучим водородным соединениям. Галогеноводороды – бесцветные ядовитый газы, с резким запахом, хорошо растворимые в воде.
В ряду HCl – HBr – HI увеличивается длина связи и ковалентности связи уменьшается полярность связи H – Hal.
Растворы галогеноводородов в воде (за исключением фтороводорода) – сильные кислоты. Водный раствор фтороводорода – слабая кислота.
Способы получения галогеноводородов
В лаборатории галогеноводороды получают действием нелетучих кислот на хлориды металлов.
Галогеноводороды получают также прямым взаимодействием простых веществ:
Химические свойства галогеноводородов
2HCl + CaO → CaCl2 + H2O
HCl + NaOH → NaCl + H2O
Fe + 2HCl → FeCl2 + H2
HF ↔ H + + F –
Водные растворы хлороводорода (соляная кислота), бромоводорода и йодоводорода – сильные кислоты, в разбавленном растворе диссоциируют практически полностью:
HCl ↔ H + + Cl –
3. Водные растворы галогеноводородов взаимодействуют с солями более слабых кислот и с некоторыми растворимыми солями (если образуется газ, осадок, вода или слабый электролит).
Качественная реакция на галогенид-ионы – взаимодействие с растворимыми солями серебра.
При взаимодействии соляной кислоты с нитратом серебра (I) образуется белый осадок хлорида серебра:
HCl + AgNO3 = AgCl↓ + HNO3
Осадок бромида серебра – бледно-желтого цвета:
HBr + AgNO3 = AgBr↓ + HNO3
Осадок иодида серебра – желтого цвета:
HI + AgNO3 = AgI↓ + HNO3
Фторид серебра – растворимая соль, поэтому реакция плавиковой кислоты и ее солей с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
4. Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
Br2 + 2HI → I2 + 2HBr
А вот хлор не может вытеснить фтор из фтороводорода.
Фтороводород практически невозможно окислить.
Концентрированная соляная кислота окисляется соединениями марганца с валетностью выше II или соединениями хрома (VI).
Например : концентрированная соляная кислота окисляется оксидом марганца (IV):
Бромоводород – сильный восстановитель и окисляется соединениями марганца, хрома (VI), концентрированной серной кислотой и другими сильными окислителями:
Бромоводород реагирует с бихроматом калия с образованием молекулярного брома:
Или с оксидом марганца (IV):
Пероксид водорода также окисляет бромоводород до молекулярного брома:
Йодоводород – еще более сильный восстановитель, и окисляется другими неметаллами и даже такими окислителями, как соединения железа (III) и соединения меди (II).
2HI + 2FeCl3 → I2 + 2FeCl2 + 2HCl
или с сульфатом железа (III):
или молекулярной серой при нагревании:
2HI + S → I2 + H2S
5. Плавиковая кислота реагирует с оксидом кремния (IV) (растворяет стекло):
Галогениды металлов
Галогениды – это бинарные соединения галогенов и металлов или некоторых неметаллов, соли галогеноводородов.
Способы получения галогенидов
При взаимодействии железа с хлором образуется хлорид железа (III):
3Cl2 + 2Fe → 2FeCl3
2. Галогениды металлов можно получить при взаимодействии металлов с галогеноводородами.
Fe + 2HCl → FeCl2 + H2
3. Галогениды металлов можно получить при взаимодействии основных и амфотерных оксидов с галогеноводородами.
2HCl + CaO → CaCl2 + H2O
Еще пример : взаимодействие оксида алюминия с соляной кислотой:
4. Галогениды металлов можно получить при взаимодействии оснований и амфотерных гидроксидов с галогеноводородами.
HCl + NaOH → NaCl + H2O
Или при взаимодействии гидроксида меди (II) с соляной кислотой:
Гидроксид цинка (II) также взаимодействует с соляной кислотой:
5. Некоторые соли взаимодействуют с галогеноводородами с образованием галогенидов металлов.
HBr + NaHCO3 → NaBr + CO2↑ + H2O
Взаимодействие с нитратом серебра – качественная реакция на соляную кислоту, бромодоводород и йодоводород:
HCl + AgNO3 → AgCl↓ + HNO3
HBr + AgNO3 → AgBr↓ + HNO3
HI + AgNO3 → AgI↓ + HNO3
Химические свойства галогенидов
NaCl + AgNO3 → AgCl↓ + NaNO3
Фторид серебра – растворимая соль, поэтому реакция фторидов с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
Mg + CuCl2 → MgCl2 + Cu
Обратите внимание! В растворе более активные металлы вытесняют менее активные только если более активные металлы не взаимодействуют с водой (металлы, расположенные в ряду активности до магния). Если добавляемый металл слишком активен, то он провзаимодействует с водой, а не с солью.
Na + ZnCl2(раствор) ≠
3. Галогениды подвергаются электролизу в растворе или расплаве. При этом на аноде образуются галогены.
2KBr → 2K + Br2
При электролизе раствора бромида калия на катоде выдялется водород, а на аноде также образуется бром:
Еще пример : йодид калия окисляется соединениями меди (II) и соединениями железа (III):
4KI + 2CuCl2 → 2CuI↓ + I2↓ + 4KCl
2KI + 2FeCl3 → I2↓ + 2FeI2 + 2KCl
Еще несколько примеров восстановительных свойств галогенидов:
KI + 3H2O + 3Cl2 → HIO3 + KCl + 5HCl
Более активные галогены вытесняют менее активные из солей.
При этом галогениды металлов не горят в кислороде.
6. Нерастворимые галогениды под действием света разлагаются на галоген и металл.
2AgCl → 2Ag + Cl2
Кислородсодержащие кислоты галогенов
Рассмотрим кислородсодержащие кислоты галогенов на примере хлора:
| Степень окисления галогена | +1 | +3 | +5 | +7 |
| Формула | HClO | HClO2 | HClO3 | HClO4 |
| Название кислоты | Хлорноватистая | Хлористая | Хлорноватая | Хлорная |
| Устойчивость и сила | Существует только в растворах, слабая кислота | Существует только в растворах, слабая кислота | Существует только в растворах, сильная кислота | Сильная кислота |
| Название соответствующей соли | Гипохлориты | Хлориты | Хлораты | Перхлораты |
Хлорноватистая кислота и ее соли
Хлорноватистая кислота HClO устойчива только в разбавленном водном растворе.
Cпособ получения хлорноватистой кислоты:
1. Диспропорционирование хлора в холодной воде :
Cl2 + H2O ↔ HCl + HClO
Химические свойства хлорноватистой кислоты:
Хлорноватистая кислота HClO – это слабая кислота, но сильный окислитель.
1. Под действием ультрафиолета (на свету) хлорноватистая кислота разлагается :
2HClO → 2HCl + O2
HClO + KOH → KClO + H2O
HClO + 2HI → HCl + I2 + H2O
4. Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
1. Более сильные кислоты вытесняют гипохлориты из солей.
NaClO + 2HCl → NaCl + Cl2 + H2O
Серная кислота реагирует с гипохлоритом кальция при нагревании или под действием излучения:
Даже угольная кислота вытесняет гипохлориты:
3. При нагревании гипохлориты разлагаются :
Хлористая кислота и ее соли
Хлористая кислота HClO2 – существует только в водных растворах.
Способы получения:
Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
Химические свойства хлористой кислоты:
1. Хлористая кислота является также слабой. Реагирует с щелочами с образованием хлоритов:
2. При длительном хранении разлагается:
Хлорноватая кислота и ее соли
Хлорноватая кислота HClO3 – также существует только в водных растворах.
Способы получения:
Хлорноватую кислоту можно получить из солей хлорноватой кислоты – хлоратов.
Химические свойства хлорноватой кислоты:
1. Хлорноватая кислота – сильная кислота. Реагирует с щелочами с образованием хлоратов:
2. Хлорноватая кислота – сильный окислитель.
Химические свойства солей хлорноватой кислоты – хлоратов:
1. Хлораты – сильные окислители.
4KClO3 → 3KClO4 + KCl
В присутствии катализатора (оксид марганца (IV)) хлорат калия разлагается, окисляя кислород:
2KClO3 → 2KCl + 3O2↑
Еще пример : хлорат калия окисляет серу и фосфор:
2KClO3 + 3S → 2KCl + 3SO2
Хлорная кислота и ее соли
Хлорная кислота HClO4 – это бесцветная жидкость, хорошо растворимая в воде.
Способы получения:
Хлорную кислоту можно получить из солей хлорной кислоты – перхлоратов.
Химические свойства хлорной кислоты:
1. Хлорная кислота – сильная кислота. Реагирует с щелочами с образованием перхлоратов:
2. Хлорная кислота – сильный окислитель.
3. При нагревании хлорная кислота разлагается:
Химические свойства солей хлорной кислоты – перхлоратов:
1. Перхлораты – сильные окислители.
Еще пример : перхлорат калия окисляет алюминий: