Водородное соединение что это
Гидриды
Водородные соединения – это сложные вещества, состоящие из двух элементов, один из которых водород. Водородные соединения разделяют на солеобразные гидриды и летучие водородные соединения.
Летучие водородные соединения НЭ – это соединения неметаллов с водородом. Степень окисления водорода равна +1.
| Летучие водородные соединения НЭ – это соединения неметаллов с водородом | Солеобразные гидриды ЭН – это соединения металлов IA, IIA групп и алюминия с водородом |
| Степень окисления водорода равна +1. Для солеобразных гидридов характерны некоторые свойства солей: гидролиз, обменные реакции и т.д. | |
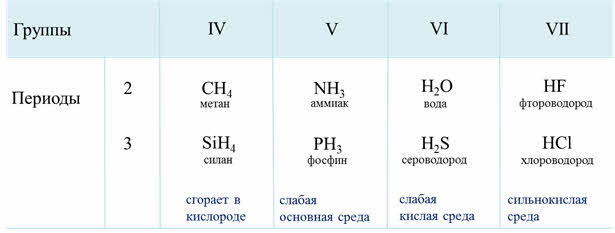
| Элементы IVА гр.: ЭН4 (SiH4 – силан, CH4 – метан) Элементы VА гр.: ЭН3 (NH3 — аммиак, PH3 — фосфин, AsH3 – арсин, SbH3 – стибин) Элементы VIА гр.: Н2Э (Н2S – сероводород, H2Se – селеноводород, Н2Те – теллуроводород и т.д.) Элементы VIIА гр.: НЭ (НF – фтороводород, хлороводород и т.д.) | NaH – гидрид натрия, CaH2 – гидрид кальция и т.д. |
Стибин SbH3 (сурьмянистый водород) — неорганическое бинарное химическое соединение сурьмы с водородом, имеющее чесночный запах.
Арсин AsH3 (мышьяковистый водород, гидрид мышьяка) — гидрид мышьяка, химическое соединение мышьяка и водорода. При нормальных условиях — ядовитый бесцветный газ. Абсолютно чистый химически арсин запаха не имеет, но ввиду неустойчивости продукты его окисления придают арсину чесночный запах. Сильный восстановитель.
Водород: химия водорода и его соединений
Водород
Положение в периодической системе химических элементов
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии :
+1H 1s 1 1s
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Соединения водорода
Типичные соединения водорода:
| Степень окисления | Типичные соединения |
| +1 | кислоты H2SO4, H2S, HCl и др. вода H2O и др. летучие водородные соединения (HCl, HBr) кислые соли (NaHCO3 и др.) основания NaOH, Cu(OH)2 основные соли (CuOH)2CO3 |
| -1 | гидриды металлов NaH, CaH2 и др. |
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов :
2Na + H2 → 2NaH
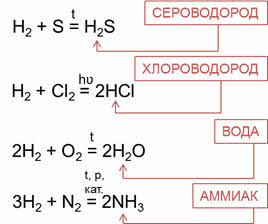
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
2. Водород взаимодействует со сложными веществами:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Способы получения
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
2Na + H2 → 2NaH
Гидрид кальция можно получить из кальция и водорода:
Химические свойства
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором :
NaH + Cl2 = NaCl + HCl
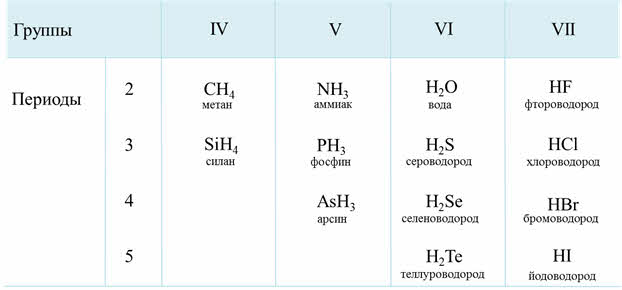
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
Соли фосфония неустойчивые, легко гидролизуются.
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
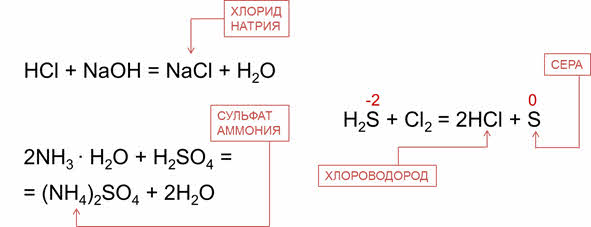
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
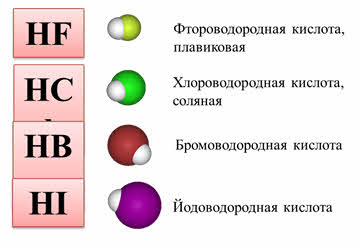
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
Ag + Н2O ≠
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
6. Бинарные соединения неметаллов также гидролизуются водой.
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Водородная связь
Межмолекулярные взаимодействия
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи.
Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородные связи возникают между следующими веществами:
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Водородное соединение что это
Водородные соединения неметаллов представляют собой газообразные соединения, кроме воды. Они летучие и легкоподвижные, быстроиспаряемые.
Электроотрицательность неметаллов больше электроотрицательности водорода, поэтому в водородных соединениях неметаллы проявляют минимальную отрицательную степень окисления: углерод — минус четыре, азот — минус три, фосфор — минус три и так далее.
Водородные соединения неметаллов проявляют основные, кислотные или амфотерные свойства. Водородные соединения неметаллов являются, как правило, сильными восстановителями.
Водородные соединения неметаллов можно получить непосредственно взаимодействием неметалла с водородом. Сероводород можно получить реакцией водорода с серой, хлороводород – реакцией водорода с хлором, воду – реакцией водорода и кислорода, аммиак – реакцией водорода и азота.
В водородных соединениях присутствует ковалентная полярная связь, они имеют молекулярную кристаллическую решётку.
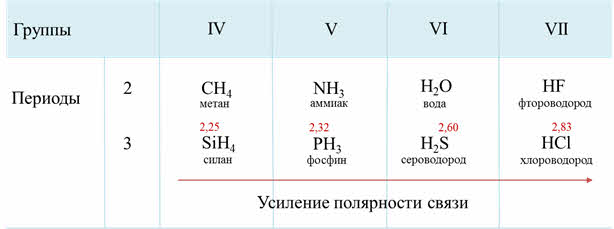
Как известно, электроотрицательность усиливается по периоду слева направо, поэтому полярность связи в водородных соединениях возрастает, а в группах сверху вниз электроотрицательность уменьшается, поэтому и полярность связи будет уменьшаться.
Если рассмотреть третий период, то от силена до хлороводорода будет наблюдаться усиление полярности связи из-за увеличения электроотрицательности неметаллов.
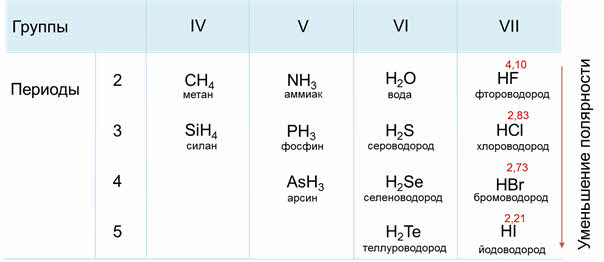
В седьмой A группе сверху вниз будет идти уменьшение полярности связи от фтороводорода к йодоводороду, потому что идёт уменьшение электрооотрицательности элемента-неметалла в водородном соединении.
Полярность связи влияет на растворимость водородного соединения в воде. Например, так как молекула воды сильно полярна, то возникает сильное межмолекулярное взаимодействие с образованием водородных связей.
Если рассмотреть водородные соединения неметаллов третьего периода, то здесь можно проследить следующую закономерность: при растворении в воде силана не наблюдается проявление кислотно-основного характера соединения, он сразу сгорает в кислороде, фосфин в воде даёт слабую основную среду, сероводород – слабую кислую среду, а хлороводород – сильнокислую среду. Это объясняется тем, что от силана до хлороводорода радиус иона неметалла уменьшается, а заряд ядра увеличивается, полярность связи в молекулах возрастает, поэтому усиливаются кислотные свойства.
В группах сверху вниз кислотные свойства водородных соединений неметаллов усиливаются, так как прочность связи водород-элемент уменьшается, из-за увеличения длины связи.
Например, водородные соединения седьмой A группы: хлороводород, бромоводород, йодоводород в воде – это сильные кислоты, которые полностью диссоциируют. Из этих кислот самой слабой является фтороводородная. Это объясняется тем, что у фтора самый маленький радиус, кроме этого, в этой молекуле присутствуют межмолекулярные водородные связи.
Таким образом, в периодах и группах главных подгруппах с увеличением заряда ядер элементов-неметаллов усиливаются кислотные свойства, а ослабевают основные свойства.
Например, водный раствор хлороводорода – проявляет кислотные свойства, поэтому реагирует со щелочами. Так, в реакции соляной кислоты с гидроксидом натрия образуется соль – хлорид натрия и вода. Водный раствор аммиака проявляет основные свойства, поэтому реагирует с кислотами. Так, в реакции аммиака с серной кислотой образуется сульфат аммония и вода.
Как было сказано, водородные соединения неметаллов проявляют восстановительные свойства, так как элемент-неметалл здесь в минимальной степени окисления. Например, в реакции сероводорода с хлором сероводород является восстановителем, потому что сера повышает свою степень окисления с минус двух до нуля.
Таким образом, все солеобразующие оксиды, образованные неметаллами, обладают кислотными свойствами, а сила кислотного оксида зависит от степени окисления неметалла и радиуса иона. В периодах слева направо кислотный характер гидроксидов, образованных оксидами неметаллов усиливается, а в группах сверху вниз кислотный характер гидроксидов ослабевает. В периодах слева направо кислотные свойства летучих водородных соединений элементов в водных растворах усиливаются. В группах сверху кислотные свойства водородных соединений увеличиваются. Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами, реагируют с кислотами.
Домашнее задание: выполните в тетрадь один из предложенных вариантов.
Цель: Рассмотрите строение метана и силана, особенности их свойств.
1. Строение молекулы метана.
а) определите тип химической связи, изобразите механизм образования химической связи в молекуле метана;
б) составьте электронную и структурную формулы метана;
в) охарактеризуйте пространственное строение метана;
г) исчерпаны ли валентные возможности атома углерода в молекуле метана;
2. Химические свойства метана.
а) отношение к воде;
б) взаимодействие с галогенами, азотной и серной кислотами. Составьте УХР этих взаимодействий.
в) отношение к нагреванию без доступа кислорода воздуха. Составьте УХР разложения метана.
г) взаимодействие СН4 и SiH4 с кислородом. Составьте УХР горения метана и силана. Чем отличаются реакции взаимодействия с кислородом метана и силена?
Цель: Изучить строение и свойства водородных соединений азота и фосфора.
1. Строение молекул аммиака и фосфина.
а) определите тип химической связи в молекулах NH3 и PH3. Какой тип кристаллической решетки имеют вещества?
б) опишите физические свойства этих соединений.
в) составьте электронную формулу аммиака, охарактеризуйте пространственное строение аммиака.
2. Химические свойства аммиака.
а) отношение аммиака к воде и кислотам. Составьте УХР этих взаимодействий.
б) окислительно – восстановительные свойства аммиака. Составьте УХР следующих взаимодействий:
— взаимодействие с кислородом при различных условиях;
— взаимодействие с оксидом меди ( II );
— хлор и бром энергично окисляют аммиак до азота.
Чем в этих ОВР выступает аммиак?
Демонстрация: Получение аммиака и растворение его в воде.
Цель: Изучить строение молекулы воды и ее свойства.
а) Составьте электронную и структурную формулы молекулы воды;
б) Каково пространственное строение молекулы воды?
в) Исчерпаны ли валентные возможности воды?
г) Физические свойства воды.
2. Химические свойства воды.
а) отношение воды к неорганическим веществам:
— кислотным и основным оксидам;
Составить возможные УХР.
б) отношение к органическим веществам:
— сложным эфирам (жирам);
Составьте возможные УХР.
в) окислительно-восстановительные свойства воды:
— взаимодействие воды с натрием, углем.
Цель: Изучить строение и свойства сероводорода.
1. Строение молекулы сероводорода:
а) Составьте электронную и структурную формулы молекулы H2S
б) Особенности пространственного строения молекулы сероводорода.
2. Физические и химические свойства сероводорода:
а) особенности физических свойств;
б) химические свойства:
— кислотно-основные (приведите примеры УХР, где сероводород проявляет кислотные свойства);
Составить УХР горения H 2 S в кислороде. Закончите УХР взаимодействия сероводорода с раствором перманганата калия в кислой среде (уравнять методом полуреакций).
Цель: Рассмотреть строение и свойства галогеноводородов.
1. На примере хлороводорода рассмотрите электронное строение молекулы. Изобразите электронную и структурную формулы молекулы хлороводорода.
2. Как изменяется сила кислот в ряду HF-HCl-HBr-HI? Почему?
3. Химические свойства галогеноводородов на примере HCl.
— охарактеризуйте отношение водородных соединений галогенов к органическим веществам:
Составьте возможные УХР взаимодействия HCl с органическими веществами.
Домашнюю работу высылать не нужно, просмотрю в школе